文献解读 | 设计 mRNA 疫苗设计的关键策略
mRNA疫苗的历史
mRNA疫苗的原理是mRNA是一种中间信使,通过各种途径传递到宿主细胞中后,被翻译成抗原。RNA 分子已被用作治疗和研究工具二十多年,其应用领域包括体外转录 (IVT) mRNA、小干扰 RNA (siRNA)、RNA适配体、核糖开关、反义 RNA 到最近开发的 mRNA 疫苗。在80 年代后期,将mRNA 分子直接输送到细胞中以操纵基因表达或产生感兴趣的蛋白质的想法首次得到测试。Malone等首次证明了使用阳离子脂质 N-[1-(2,3-二烯氧基)丙基]-N,N,N-三甲基氯化铵可以在NIH 3T3成纤维细胞中高效转染mRNA 。在接下来的二十年左右的时间里,将 mRNA 分子转染到宿主细胞中以表达感兴趣的基因的想法经历了几次技术改进。
在 1990 年代初期,首先通过将编码荧光素酶和 β-半乳糖苷酶等报告基因的 RNA 载体递送到鼠肌肉细胞并将加压素 mRNA 转染到大鼠体内以逆转尿崩。1993 年,Martinson等人证明了体外合成的编码流感病毒核蛋白的mRNA 疫苗触发了小鼠细胞毒性T 淋巴细胞的激活。后来,发现mRNA在体内的应用同时诱导细胞毒性T细胞的激活和B细胞的体液反应以产生特异性抗体。
然而,由于 RNA 的易降解性、核糖核酸酶的普遍存在以及缺乏可扩展性,使用 mRNA 作为疫苗的可能性并未被认真考虑。最近出现了一系列进展,分别使用编码MUC1和单纯疱疹病毒 I 胸苷激酶的 mRNA 疫苗来预防三阴性乳腺癌和肺癌。该应用已被用于预防癌症和传染病以及治疗过敏和其他需要蛋白质替代的疾病。目前已经针对寨卡病毒、巨细胞病毒、流感病毒、偏肺病毒和副流感病毒等传染性病原体以及癌症的许多 mRNA 疫苗正在临床试验中或已可使用。
mRNA疫苗设计的优化
使用减毒活病毒或灭活病毒或假病毒系统的典型疫苗开发涉及繁琐且耗时的步骤,并且已成为应对由新出现的病毒引起的流行病或大流行的瓶颈。mRNA 疫苗具有快速开发和通用性的独特优势,譬如多种 COVID-19 mRNA 疫苗的快速开发。更重要的是,最近来自临床试验的初步数据表明,两种获得许可的 mRNA 疫苗 mRNA-1273 和 BNT162b 比使用黑猩猩腺病毒开发的 ChAdOx1 疫苗具有更高的保护功效(~95% 与~70%)。
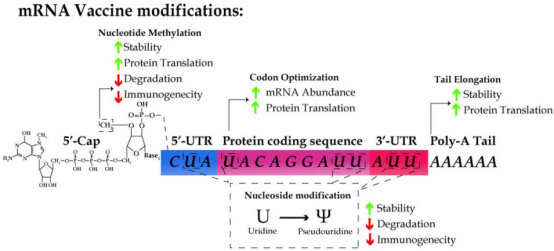
然而,mRNA分子的一些内在特征需要特殊的策略来保证mRNA疫苗的稳定性、有效性和安全性。首先,由于血清和血浆无处不在的 RNase,mRNA 本质上是不稳定的并且易于降解。其次,细胞机制将外源性 RNA 分子识别为病毒感染的免疫模拟,从而立即产生免疫反应。因此,设计 mRNA 疫苗的先决条件是最大限度地提高 RNA 的稳定性和翻译效率,避免宿主细胞的先天免疫反应。目前设计 mRNA 疫苗的主要策略主要包括以下几个方面:包括 5'-加帽、核苷修饰、密码子优化以及使用纳米粒子有效递送 mRNA 分子等。
一、mRNA 疫苗的 5'-加帽
内源性 mRNA 分子会经历转录后修饰,包括 5'-加帽和聚腺苷酸化,用于 提高mRNA的稳定性和高效的翻译。自然条件下,7-甲基鸟苷cap (m7G) 通过 5' 到 5' 连接添加到 mRNA 的第一个核苷酸上。第一个核苷酸核糖上的2’-OH进一步甲基化形成m7GpppNm,也称为cap1。5'-封顶对于保护mRNA免受外切核酸酶影响促进前mRNA剪接,为eIF4F提供结合位点,异二聚体翻译起始复合物非常关键。 近期研究已经表明 5'-帽结构是宿主区分自身与非自身 mRNA 分子之间差异的决定因素 [50-53]。端迄今为止报道的大多数 mRNA 疫苗在他们的 IVT阶段都会5'添加一种m7GpppNm帽。
二、5'-和 3'-非翻译区的优化和聚腺苷酸化尾巴的长度
5' UTR的调控元件和 3'-UTR的长度可以促进蛋白质翻译。除此之外,聚腺苷酸化 (polyA) 尾部可以稳定 mRNA 和促进蛋白质翻译。最近的几篇报道已经表明polyA尾的长度与翻译效率密切相关。
三、IVT期间的核苷修饰
Kariko 等人证明,mRNA分子中核苷的修饰可以抑制Toll 样受体 (TLR) 的 RNA 识别通过。mRNA 分子的m5C、m6A、m5U、s2U 或假尿苷修饰转化可以逃避 TLR-3,-7 和-8的激活的免疫反应。已报道的七种疫苗都将mRNA 中的尿苷代替成假尿苷。 除此之外,mRNA 中的假尿苷、m6A 和 s2U 修饰可以抑制RNA分子被RNase L降解。因此,核苷修饰不仅增强了 RNA 的稳定性,还降低了先天免疫反应。
四、 IVT的纯化
IVT 过程中的污染杂质一旦被引入人体细胞会严重影响mRNA疫苗的安全性。 即使残留的双链 RNA 和 DNA-RNA 杂交分子也可以触发先天免疫反应,因为它们可以被细胞模式识别受体识别。目前正在临床试验的七种 mRNA 疫苗都在用各种各样的纯化技术去除IVT 反应的残留杂质。 一项先前的研究表明,纯化mRNA 可以降低 I 型干扰素的表达,增加蛋白质翻译。如表 2 中总结,各种纯化技术如Oligo dT 色谱柱、氯化锂沉淀和硅胶柱已被用于去除来自体外合成mRNA的污染物。
五、密码子优化
密码子优化从翻译效率、蛋白质折叠和 mRNA 丰度几个参数考虑。一个例子是序列中的GC含量。尽管富含 GC 的序列可能不利于mRNA的二级结构形成,但富含 GC 的序列的翻译效率比GC缺乏的序列高 100 倍。翻译延伸率高度依赖于同源 tRNA 种类的可用率,优化密码子使用以避免序列匹配稀有 tRNA,整合序列匹配更丰富的tRNA种类。 此外,密码子优化对于mRNA 稳定性十分重要要,因为密码子依赖的翻译延伸率被认为是mRNA 稳定性的主要决定因素。从机制上讲,次优密码子造成的mRNA翻译延伸的减少会招募DEAD-box RNA解旋酶,Dhh1p,进而触发 mRNA 衰减。双重密码子优化方法涉及使用人类偏见和最大适应指数的密码子。 其他生物信息学可以探索进一步提高mRNA 的稳定性,例如,通过深度学习设计二级结构和预测表达水平。
六、用脂质纳米颗粒(LNP)高效递送mRNA 疫苗
原始出处:Park J W , Lagniton P , Liu Y , et al. mRNA vaccines for COVID-19: what, why and how[J]. International Journal of Biological Sciences, 2021, 17(6):1446-1460.
